营养支持作为常规围手术期的辅助治疗手段之一往往能改善患者预后,延长患者寿命,目前已将营养治疗推荐为一线治疗方式。营养物质不仅为患者提供必要的能量基础,有些营养制剂更是可以抑制肿瘤细胞,预防癌症。本综述将紧扣“肿瘤免疫”的主题,构建营养、免疫和癌症三者之间的密切联系。讨论一些营养物质通过调节机体免疫系统,影响免疫细胞功能,进而改善癌症患者预后,甚至延长患者生命。
1 肿瘤免疫概述
肿瘤和免疫系统之间的关系分为三个阶段,首先是免疫效应细胞消除恶性转化细胞;紧接着,恶性细胞与肿瘤病灶内的免疫反应达到平衡;最后,癌细胞最终逃脱免疫控制,出现增生进展和转移[1]。有效的癌症化学药物治疗(以下简称化疗)或放射治疗(以下简称放疗)通过重新激活免疫监测,增加癌细胞的免疫原性,释放危险相关模式分子(danger-associated molecular patterns,DAMP) [2],消耗免疫抑制白细胞。免疫抑制白细胞包括骨髓来源的抑制性细胞(mye-loid-derived suppressor cells,MDSCs )如树突状细胞(dendritic cells, DCs)、巨噬细胞和(或)粒细胞的前体,还有调节性T细胞(reyulatory T cells,Treg),它们具有显著抑制免疫细胞应答的能力[3]。同样,免疫检查点阻滞剂的免疫治疗可以重新激活由耗尽T细胞介导的抗癌反应,重新建立免疫平衡状态[4]。
2 各营养及补充剂与肿瘤免疫
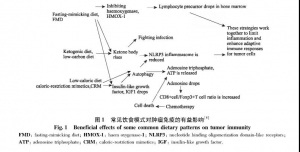
2.1 饮食模式[5]
2.2 氨基酸[11]
关于氨基酸,体外实验和动物实验[12-13]表明,低浓度和高浓度的精氨酸对肿瘤免疫都有负面影响。低浓度的精氨酸将导致肿瘤微环境中淋巴细胞的浸润减少。然而,增加的精氨酸浓度最终将导致持续产生的一氧化氮和高浓度的多胺,这有助于肿瘤细胞的增生和发育[14]。因此,平衡浓度的精氨酸才能更好地发挥肿瘤抑制作用[15-16] 。谷氨酰胺也非常类似,较低的谷氨酰胺导致自然杀伤细胞(natural killer cell,NK)的细胞毒性功能降低,引发肿瘤细胞的免疫逃逸。但患者的谷氨酰胺浓度增加可激活树突细胞上的谷氨酸受体4进而影响Th17细胞应答[17-18],也导致肿瘤细胞增生和肿瘤生长,此外肿瘤部位的高浓度谷氨酰胺会导致负氮平衡,引发恶病质[19]。所以,抑制肿瘤也要平衡谷氨酰胺的浓度。
2.3 ω-3多不饱和脂肪酸
结肠经常暴露在来自食物、肠道菌群和病原体的各种抗原环境中,肠道免疫系统在维持免疫和恶性转化微妙平衡方面具有重要的地位[20]。肠道Treg细胞抑制了效应T细胞(effect T cell,Teff)的免疫反应,把控并调节肠道免疫反应的强度,维持肠道稳态。虽然Foxp3 + Treg细胞可以抑制肠道微生物群或无害的饮食抗原所引发的异常免疫反应,但它们也会抑制抗肿瘤的免疫监测进而促进肿瘤逃避[21]。队列研究结合动物实验[22]表明,深海鱼油ω-3多不饱和脂肪酸,即二十碳五烯酸、二十二碳五烯酸、二十二碳六烯酸,可以发挥免疫调节T细胞增生和凋亡的作用。深海鱼油ω-3通过降低结肠Treg细胞对Teff细胞的抑制作用进而抗结直肠癌,因此建议深海鱼油ω-3用于结直肠癌的预防和治疗。
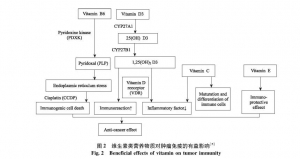
2.4 维生素
2.5 膳食纤维
膳食纤维增加了结肠固有层和外周血中CD8 + T细胞的比例,提高了NK细胞的活性。可溶性纤维可以被肠道细菌发酵成短链脂肪酸(short-chain fattyacid,SCFAs),参与肠道免疫反应的调节和对结直肠癌的预防[25]。另外短链脂肪酸还可以降低循环炎性反应细胞因子,其中丁酸盐作为正常结肠细胞的主要能量来源,是一种组蛋白去乙酰化酶抑制剂,组蛋白去乙酰化酶抑制剂能有选择性地恢复癌症抑制因子和其他抗癌基因的表达,间接地抑制血管生成因子的表达,帮助阻断对肿瘤的血液供应。另外丁酸盐与程序性死亡受体-配体1肿瘤免疫治疗具有协同作用,可以促进T细胞浸润,增强肿瘤相关T细胞功能,丁酸盐还能与G蛋白偶联受体作用促进结肠巨噬细胞和树突状细胞的抗炎特性,从而诱导Tregs分化[26]。总之膳食纤维可以改善结直肠癌患者的生存率,并降低结直肠癌和胰腺癌的患病风险[27]。
2.6 微量元素[11]
缺锌会影响免疫细胞的发育[28]及其功能。锌摄入量与胃癌、食管癌和结直肠癌风险呈负相关[29]。然而,较高浓度的锌(血清浓度大于30um)反过来会抑制免疫细胞功能。锌在免疫调节中的作用知之甚少。文献[11]显示锌可能通过改变膜结构和受体表达来影响免疫细胞和肿瘤细胞之间的信号传导。硒也是人类必不可少的一种微量元素,硒会影响先天性和适应性免疫系统。硒缺乏导致胸腺和淋巴组织中淋巴细胞数量减少。补充硒可增强NK细胞的细胞毒性,激活IL-6和干扰素-y(interferon-y,IFN-y)途径[30],增加T细胞和CD4 +T细胞数量[31]。硒的抗肿瘤效果已基本确定,但还需明确适用剂量。
2.7 益生菌
科学家在杰克逊实验室和泰康利农场的C57小鼠身上接种了相同的黑色素瘤细胞,在这两种具有不同肠道共生微生物群的小鼠中,观察到其抗黑色素瘤免疫力的差异,杰克逊实验室的C57小鼠抗黑色素瘤的能力较强,泰康利农场的小鼠肿瘤增长速度较快,这些差异在共同饲养或粪菌移植后被消除[32]。杰克逊实验室小鼠的粪菌能够抑制肿瘤生长,并增加PD-L1特异性抗体治疗肿瘤的效果。对16 S 核糖体RNA的测序鉴定出257种差异肠道细菌,其中双歧杆菌与抗肿瘤作用密切相关。综上所述,共生双歧杆菌能够在稳定状态下调节DCs的激活[33],进而改善肿瘤特异性CD8 +T细胞效应功能,并辅助增加免疫药物PDN的疗效,改善多种肿瘤患者的预后。
3 膳食炎症指数
目前,人们意识到营养会影响炎性反应和免疫反应,因此南卡癌症防控项目通过设定膳食炎症指数(dietary inflammatory index, DII)来判断一种饮食是不是可以“抗感染” ,并可以成功预测这种饮食对炎症标志物的影响,比如高敏C反应蛋白(high sensitivity C reactive protein, hsCRP)和 IL-6[34]。因此 日常饮食中的各类食物可按照一定的标准分为抗炎性反应食物如蒜、膳食纤维、类胡萝卜素、茶、ω-3多不饱和脂肪酸、姜黄、黄酮类和豆类,促炎性反应食物如以红肉为代表的饱和脂肪和反式脂肪,通过促进或抑制体内的炎性反应微环境影响某些疾病,包括癌症的发生和发展。
4 结语与展望
文章来源:王欣,张俊璇,高健,石汉平.免疫营养改善肿瘤患者预后[J].首都医科大学学报,2020,12(41):1019-1024.